Una aleación es una mezcla de dos o más elementos químicos, donde al menos uno de ellos es un metal. El ejemplo más famoso quizás sea el acero, una aleación de hierro y carbono, aunque estamos rodeados de muchos tipos de aleaciones distintas con una gran variedad de características y aplicaciones.
Las características de las aleaciones vienen determinadas por la microestructura que forman los elementos al estar combinados, lo que depende de la composición de la aleación. Es decir, varía según la cantidad relativa de los elementos. Para analizar y comprender cómo influye la composición de la aleación, se utilizan los diagramas de equilibrio o diagramas de fases. En este artículo explicamos cómo se forman y cómo entender un diagrama de solubilidad total (tipo más sencillo), junto con la regla de la palanca. En estos enlaces podéis echarle un ojo a los diagramas de solubilidad parcial en estado sólido o al diagrama hierro-carbono.
También tenéis un vídeo con animaciones al final del artículo.
1. Microestructura de un metal puro
Para llegar a entender cómo se forma la microestructura de una aleación, debemos ir paso a paso, analizando primero qué le ocurre a un metal puro.
Un metal puro se encuentra en estado líquido si la temperatura es superior a su temperatura de solidificación (también llamada temperatura de fusión). Si se deja enfriar libremente, la temperatura irá descendiendo con el tiempo hasta alcanzar la temperatura de solidificación. En este momento, pequeños núcleos cristalinos aparecen, que comienzan a crecer en todas las direcciones del espacio formado dendritas (estructuras ramificadas). Cuando las dendritas se intersecten unas con otras, darán lugar a los granos del metal. Todo este proceso se produce a una temperatura constante.
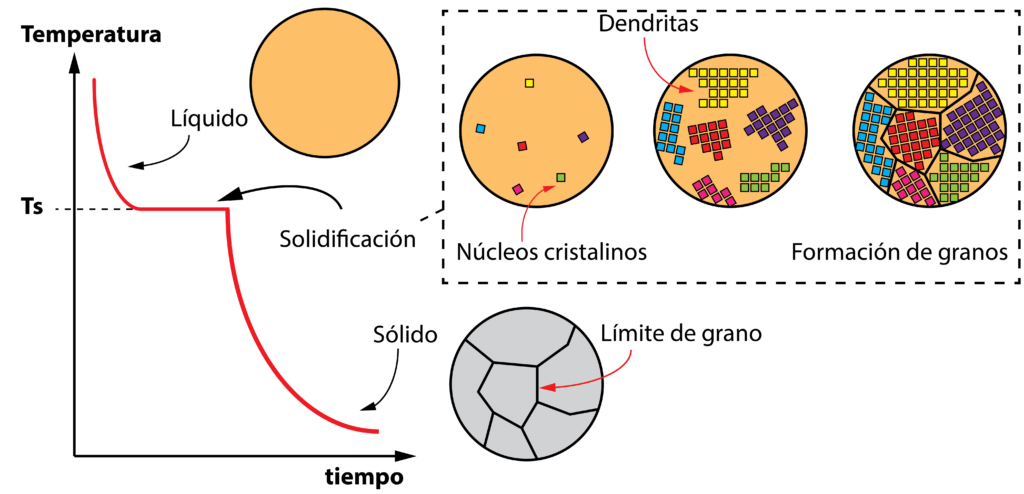
Finalmente, la temperatura desciende enfriando el metal ya solidificado hasta la temperatura ambiente. En definitiva, la microestructura de un metal puro sólido está formada por granos, cada uno con distinta orientación cristalográfica (en función del crecimiento de las dendritas) que quedan delimitados por bordes de grano. En función de variables, como por ejemplo la velocidad de enfriamiento o tratamientos térmicos, el tamaño y número de los granos puede ser distinto, afectando a las propiedades mecánicas del material.
2. ¿Cómo se forma una aleación?
Para formar una aleación es necesario mezclar un metal con otro elemento, que puede ser otro metal o no. Sin embargo, los elementos tienen que ser totalmente miscibles (que se mezclen) en estado líquido, formando un producto homogéneo, que presente un carácter metálico.
A escala microscópica, las aleaciones se componen de granos de una o varias fases, que son mezcla de los elementos con una estructura, propiedades y composición uniformes que dependen de la composición de la aleación y la temperatura. A estas fases se les conoce con el nombre de soluciones sólidas.
Las soluciones sólidas se forman cuando los átomos de los distintos elementos se combinan para formar parte de la misma red cristalina, lo que ocurre mediante dos mecanismos:
- Sustitución: cuando los átomos tienen tamaños similares, los átomos del soluto sustituyen a átomos del disolvente (componente que mantiene la estructura de su red cristalina).
- Inserción: si los átomos del soluto son más pequeños, se introducen en el interior de los cristales del disolvente.
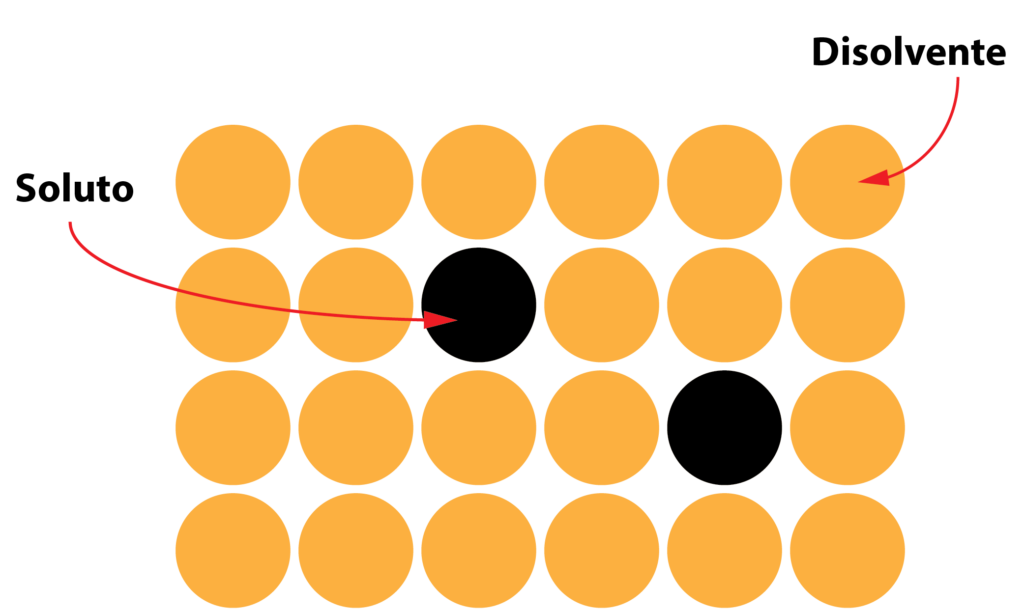

Como veis, se trata de una disolución, al igual que la sal en el agua, pero que dos elementos sólidos que se mezclan dando un producto, también sólido, de propiedades combinadas llamado solución sólida.
La curva de enfriamiento de una aleación es distinta a la de un metal puro (salvo casos especiales que veremos en otros artículos), debido a la presencia de varios elementos. Se parte de la aleación fundida en estado líquido, dejándola enfriar. Al alcanzar la temperatura de solidificación del primer elemento (el que tiene esta temperatura más alta), este empieza a solidificar. Sin embargo, el otro elemento, con un punto de solidificación más bajo sigue siendo líquido. Por ello, la etapa de solidificación no se produce a temperatura constante, si no que se da en un rango entre dos temperaturas. Al finalizar, la aleación ya es sólida, enfriándose hasta la temperatura ambiente.
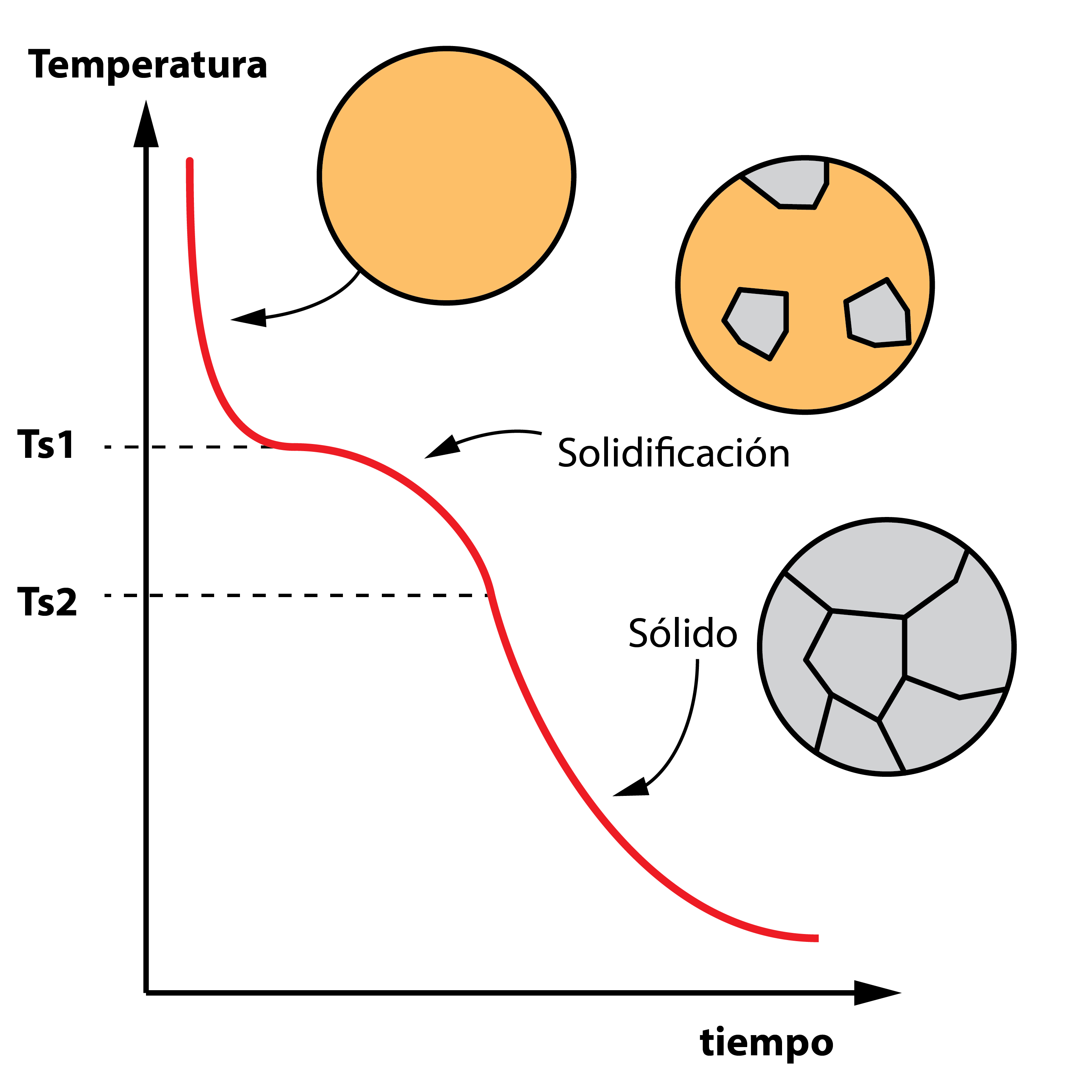
3. Diagrama de equilibrio de solubilidad total en estado sólido
Un diagrama de fases es un mapa que muestra qué fases existen en la microestructura de una aleación en función de la temperatura y de su composición. En este artículo analizamos el caso más sencillo, que se da cuando solo existe una fase en estado sólido.
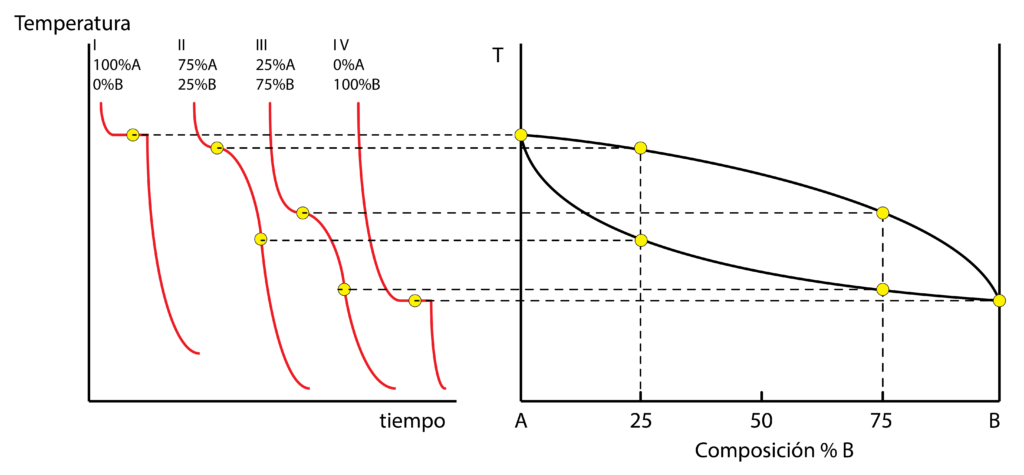
Para entender cómo se forma un diagrama de equilibrio vamos a tomar cuatro aleaciones distintas de dos componentes, A y B:
- La aleación 1 tiene un porcentaje del 100% de A y 0% de B. Es decir, es el metal puro A, cuya curva de enfriamiento ya conocemos.
- Las aleaciones 2 tiene un 75% del metal A y un 25% del metal B, por lo que su curva de enfriamiento presenta la solidificación entre dos temperaturas.
- De manera similar, la aleación 3, con un 25% de A y un 75% de B, muestra otra curva de enfriamiento.
- Por último, la aleación 4 tiene un 0% de A y un 100% de B, correspondiendo con el metal puro B, con temperatura de solidificación constante.
Si unimos los puntos de inicio y final de solidificación de todas las aleaciones, representadas en un diagrama donde el eje x indica el porcentaje de A y B, siendo el eje y la temperatura, formamos el diagrama de fases. El extremo izquierdo representa el metal puro A y el derecho el metal puro B. En todo el rango intermedio están las composiciones de las distintas aleaciones posibles.
En el diagrama se identifican dos líneas importantes:
- Línea de liquidus: por encima de ella la aleación es líquida.
- Línea de solidus: por debajo de ella toda la aleación es sólida.
En el caso de aleaciones con solubilidad total, independientemente de la composición de la aleación, se obtiene una única fase solida, una única región por debajo de la línea de solidus. Normalmente, se les nombra con letras griegas. Para este ejemplo la llamaremos fase sólida \alpha.
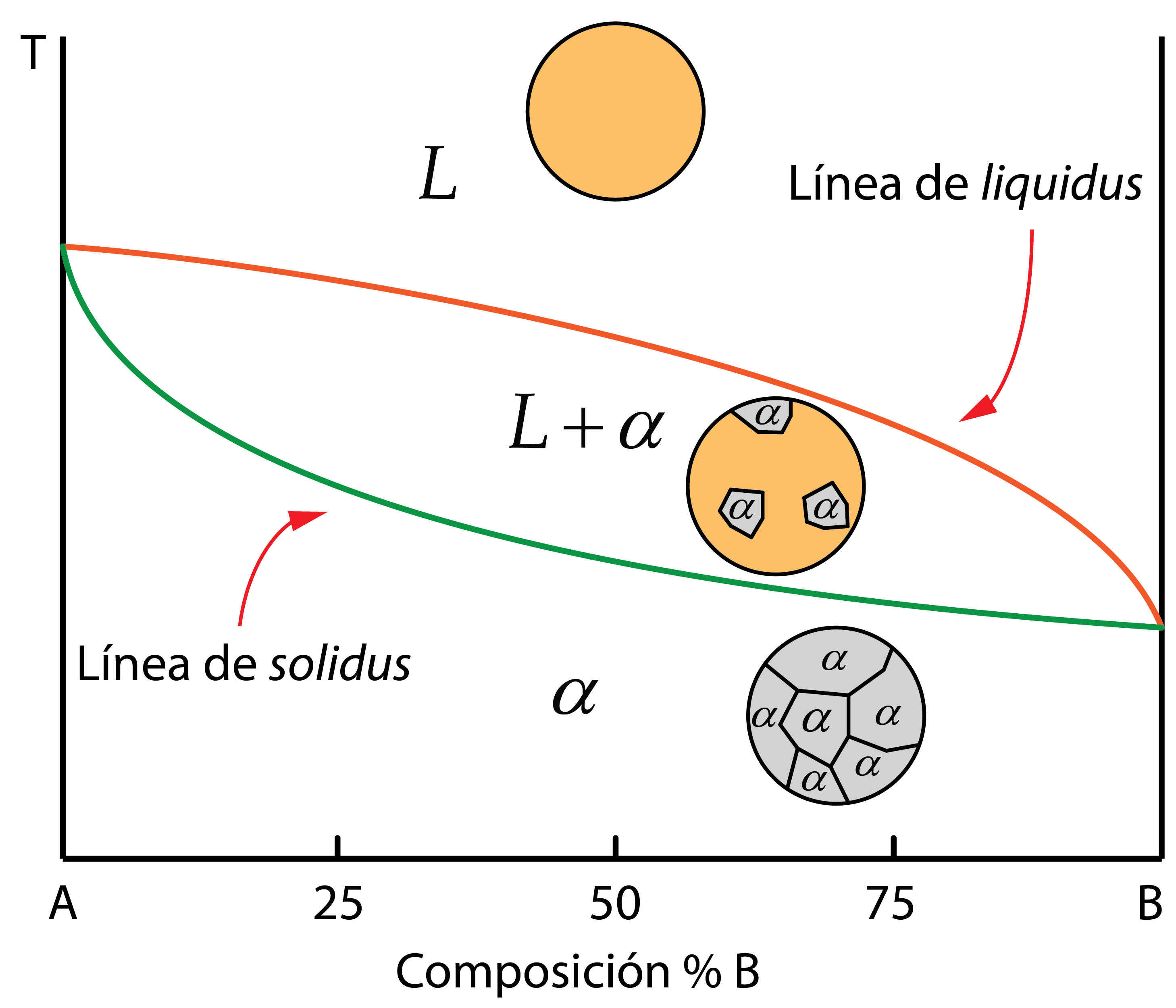
La región limitada entre las líneas de liquidus y solidus es una zona bifásica, donde conviven tanto líquido como sólido correspondiente a la fase sólida \alpha. Es decir, en esta zona, la microestructura estaría formada por líquido y granos sólidos de la fase \alpha. Por debajo de la línea de solidus, la microestructura de la aleación está formada por granos de la fase sólida \alpha. Es decir, se trata de una microestructura homogénea.
Gracias al diagrama conocemos para qué temperaturas se producen estos cambios entre fases y qué fases constituyen la microestructura del estado sólido.
4. Identificación de porcentajes y Regla de la Palanca
La utilidad del diagrama de equilibrio no es únicamente cualitativa, si no que también sirve para cuantificar porcentajes de los componentes y fases de la aleación.
Seleccionemos como ejemplo una aleación con el 30% de A y 70% de B a la temperatura de 450ºC. Se encuentra en la región bifásica, por lo que a esta temperatura tenemos líquido y solución sólida \alpha.
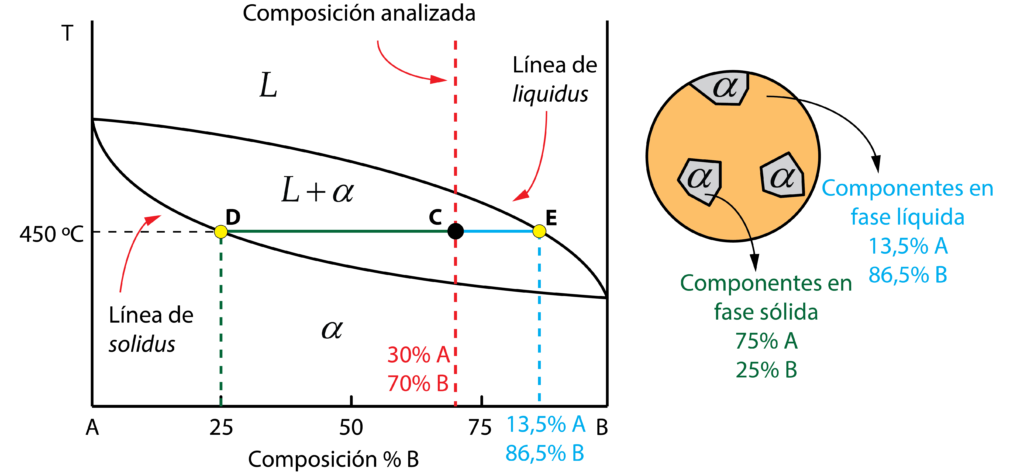
Para obtener la concentración de ambos componentes, A y B, tanto en el líquido como en \alpha hay que trazar una línea horizontal por el punto C, hasta cortar con las líneas de liquidus y solidus. La intersección con la línea de liquidus indica la concentración de los componentes en la fase líquida. Bajando verticalmente observamos un 13,5% de A y un 86,5% de B. La intersección con la línea de solidus marca la concentración de los componentes en \alpha, 25% de A y 75% de B.
Ahora ya sabemos cúanto de A y B hay en la fase líquida y en la fase sólida \alpha. ¿Pero cúanta masa de líquido y cúanta de fase sólida hay a esta temperatura? Esto se calcula con la regla de la palanca.
El segmento DE representa la masa total, el segmento CE la masa de la fase sólida, y el segmento DC la masa de líquido. Aquí un detalle: el segmento que marca la masa es el lado opuesto, por eso también se conoce como regla de la palanca inversa.
Para obtener la masa relativa de sólido se divide el segmento opuesto CE, entre el total, DE.
{M_\alpha } = \dfrac{{CE}}{{DE}} = \dfrac{{86,5 – 70}}{{86,5 – 25}} = 0,268 \to 26,8\%
De manera análoga, la masa relativa de líquido se obtiene dividiendo el segmento opuesto, DC, entre el total, DE.
{M_L} = \dfrac{{DC}}{{DE}} = \dfrac{{70 – 25}}{{86,5 – 25}} = 0,732 \to 73,2\%
Resumiendo, ahora sabemos que la aleación con una composición del 30% de A y 70%B, a 450 ºC, está formada por un 73,2% de líquido, cuya composición es 13,5% de A y 86,5% de B, y de un 26,8 % de fase sólida \alpha, de composición 75% de A y 25 % de B.
Este tipo de diagrama es muy sencillo, pero no siempre serán así. El siguiente caso es el diagrama de solubilidad parcial en estado sólido, que puedes consultar en el siguiente enlace.
Si queréis ampliar un poco más vuestros conocimientos sobre este tipo de diagramas de equilibrio os animo a ver el siguiente vídeo donde se detallan todos estos conceptos con animaciones!!
